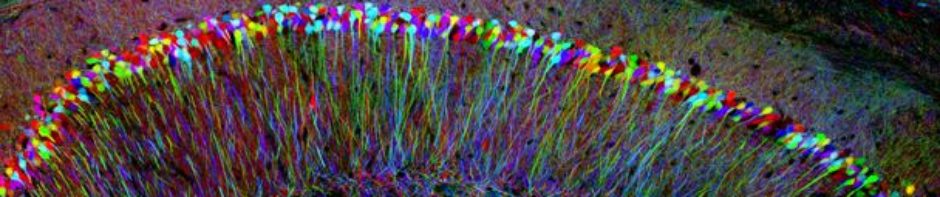
Gefeiert wird er meist als Bioingenieur und als Pionier der Optogenetik, der dieser neuen und mächtigen Methode zu Untersuchung neuronaler Schaltkreise binnen weniger Jahre zum Durchbruch verhalf. Doch als Psychiater ist Karl Deisseroth auch in der medizinischen Praxis tief verwurzelt. Mindestens einmal in der Woche sieht er Patienten, die unter Depressionen leiden, unter Schizophrenie und anderen bislang kaum verstandenen Gemütskrankheiten. „Erst allmählich kommen wir über den Punkt hinaus, wo wir psychiatrische Erkrankungen als biochemische Probleme begreifen, die durch das Ungleichgewicht bestimmter Botenstoffe entstehen“, sagt Deisseroth. Er hält diese Vorstellung für grob und ungenau und er vermutet, dass die Ursachen vielmehr in der Art und Weise liegen könnten, wie spezifische Nervenschaltkreise miteinander verbunden sind. In der Optogenetik, sieht Deisseroth deshalb auch ein neues Instrument, um die Funktion dieser Nervenschaltkreise aufzuklären und Störungen durch gezielte Stimulierung zu beseitigen.
Zwar ist die tiefe Hirnstimulation mit implantierten Elektroden bei fortgeschrittenen Parkinsonpatienten bereits ein etabliertes Verfahren, und es gibt auch erste Erfolgsberichte zur Behandlung von Depressionen mit dieser Methode. Charles Nemeroff von der Emory University School of Medicine etwa löste damit bei seinen Patienten eine „plötzliche Leichtigkeit“ aus. Sie berichteten vom „Verschwinden der Leere“ oder einem „plötzlichen Aufhellen des Raumes mit schärferen Details und intensiveren Farben“. Diese Ansätze seien aber zu ungenau und mit zu vielen Nebenwirkungen behaftet, meint Deisseroth. Ganze Hirnregionen oder Nervenknoten mit Elektroden zu stimulieren sei „wie ein Dirigent, der gleichzeitig das gesamte Orchester antreibt, anstatt die Flöten zu fordern und die Pauken zu dämpfen. Elektroden sind schnell, aber dumm.“
Dass es auch anders geht, hat Herbert Covington im Labor des renommierten Psychiaters Eric Nestler an der Mount Sinai School of Medicine in New York bereits im Tierversuch mit Mäusen demonstriert. Er erzielte mithilfe der Optogenetik bei gestressten Nagern mit Lichtblitzen eine ähnliche Wirkung wie mit Antidepressiva. Die Tiere, die vorher soziale Kontakte verweigert hatten, erlangten wieder ihr normales Artverhalten, nachdem Covington und dessen Kollegen Neuronen des präfrontalen Cortex stimuliert hatten.
Auch Garret Stuber und Antonello Bonci haben bereits einen optogenetischen Schalter in das Gehirn von Mäusen eingesetzt. Am Ernest Gallo Clinic and Research Center der University of California San Francisco untersuchten sie damit einen neuronalen Schaltkreis, der an der Regulation des Suchtverhaltens beteiligt ist. Dazu nahmen die Forscher eine anatomische Verbindung ins Visier, die sich tief im Hirn von der Amygdala entlang spezifischer Nervenfasern bis zu den Neuronen des Nucleus accumbens im Vorderhirn erstreckt. Als sie den Tieren die Gelegenheit gaben, mit der Nase auf einen Kopf zu drücken und damit einen Lichtstrahl zu erzeugen, der jene Neuronen im Nucleus accumbens aktivierte, begannen die Tiere wie wild sich selbst zu stimulieren. Das Experiment bestätigte somit die zentrale Bedeutung der Zielregion des optischen Schalters für das Suchtverhalten.
Mithilfe der Optogenetik, fasst Deisseroth zusammen, bewege sich die Psychiatrie in Richtung einer Netzwerk-Wissenschaft, die komplexe Hirnfunktionen inklusive des Verhaltens als Eigenschaften eines Systems interpretiert, die aus der elektrochemischen Dynamik der Zellen und Nervenschaltkreise erwachsen. „Als Arzt“, fügt er hinzu, „finde ich diese Entwicklung faszinierend.“
Dieser Artikel erschien in englischer Übersetzung im Magazin Futura, dem Magazin des Boehringer Ingelheim Fonds, Stiftung für Medizinische Grundlagenforschung